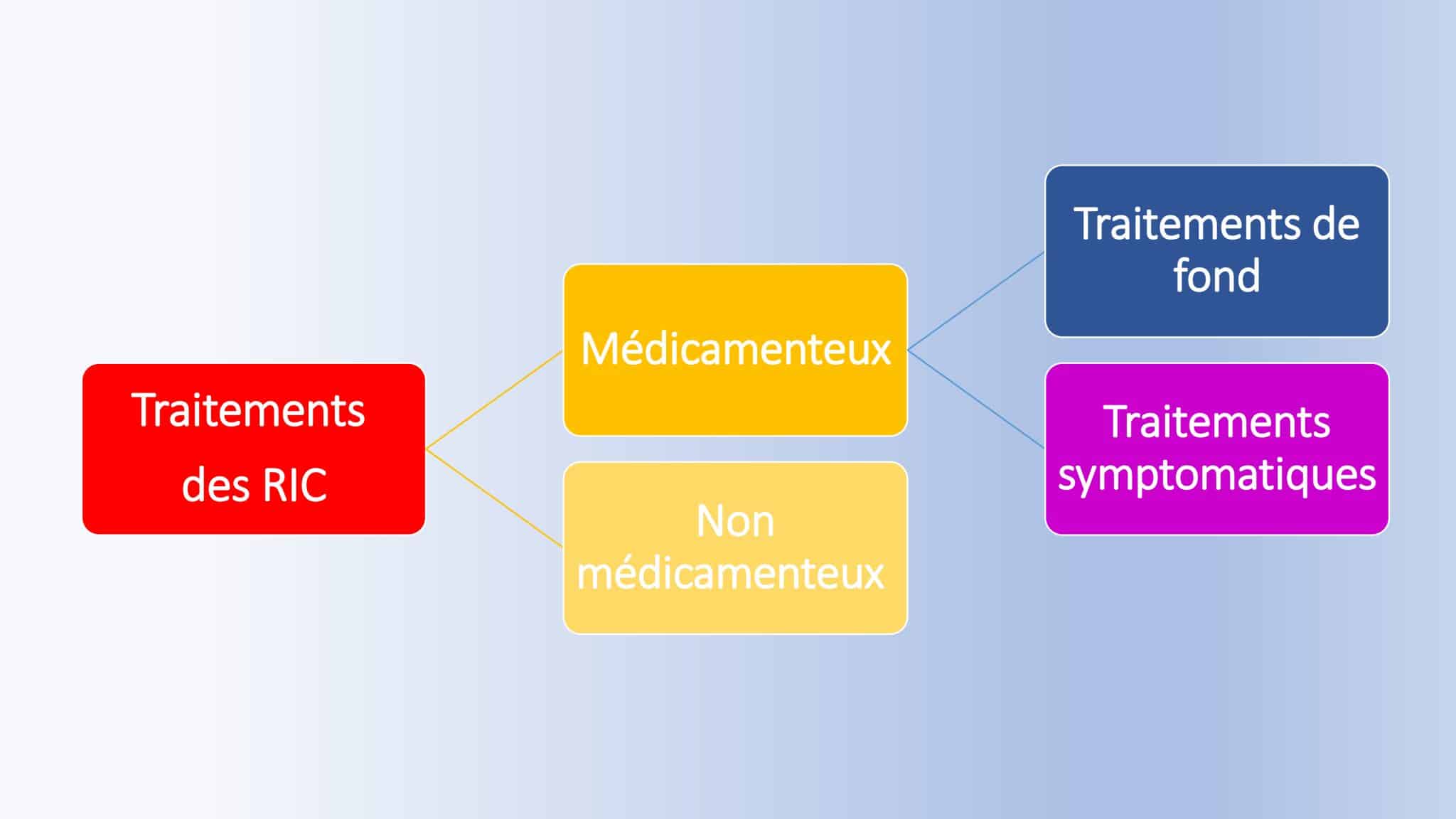
Les traitements des rhumatismes inflammatoires chroniques
La polyarthrite rhumatoïde, la spondyloarthrite, le rhumatisme psoriasique, le syndrome de Sjögren sont des maladies douloureuses. Elles peuvent être potentiellement invalidantes si elles ne sont pas prises en charge. C’est pourquoi les attentes des malades vis-à-vis des traitements des rhumatismes inflammatoires chroniques sont grandes : des douleurs soulagées, une maladie contrôlée, une autonomie retrouvée, pour une meilleure qualité de vie…
Et c’est un fait : ils sont absolument essentiels pour lutter contre la douleur et l’inflammation, si délétère dans les RIC. Néanmoins leurs effets indésirables réels ou supposés peuvent susciter des craintes, parfois irrationnelles, surtout lorsqu’on manque d’information.
En complément, les traitements non médicamenteux contribuent au maintien voire à l’amélioration de la qualité de vie. Ils permettent même, dans certains cas, de réduire les médicaments symptomatiques.

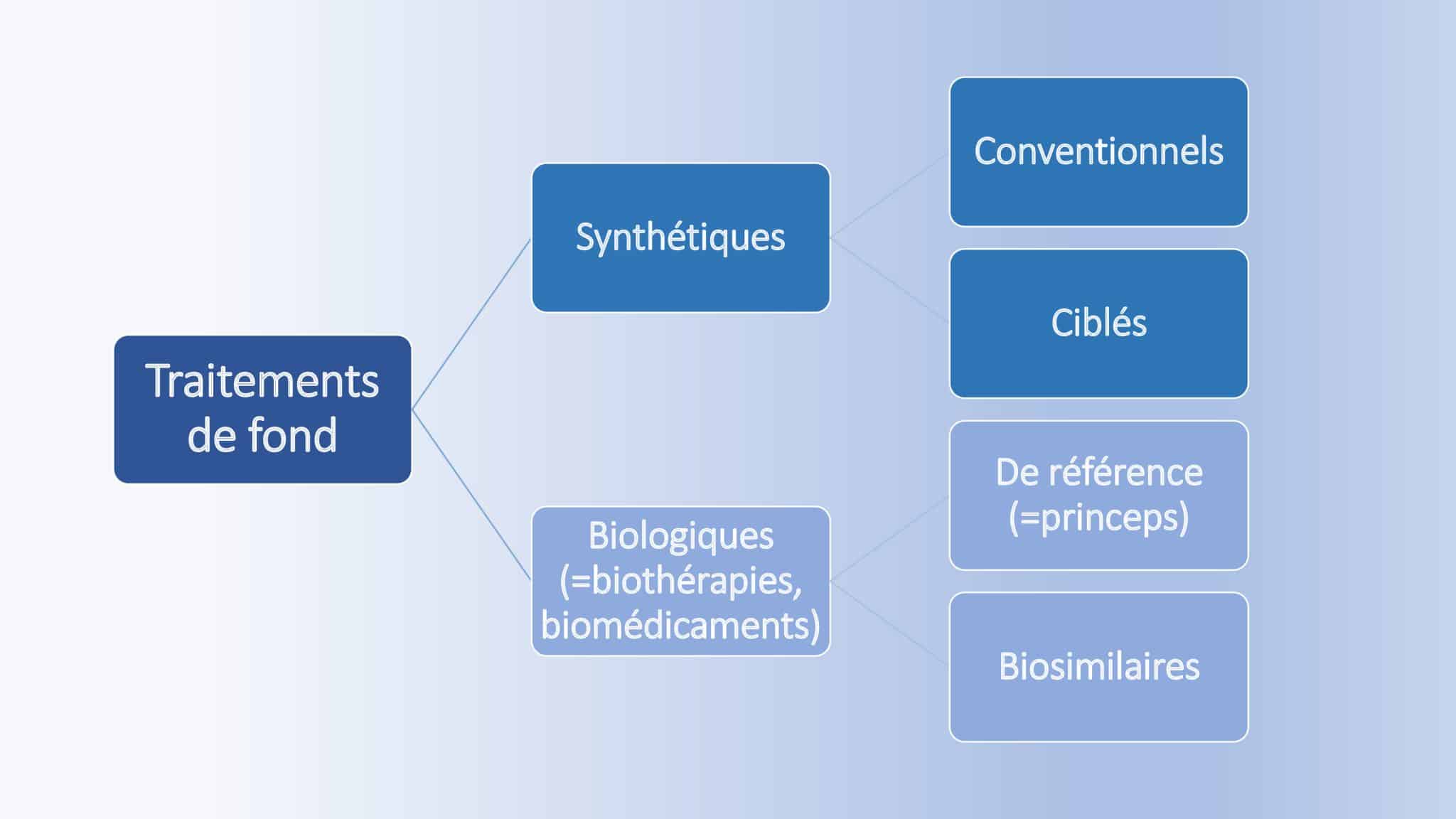
Les traitements de fond
La polyarthrite rhumatoïde, la spondyloarthrite, le rhumatisme psoriasique et les autres RIC sont des maladies chroniques. Aussi leurs traitements de fond, contrairement aux traitements symptomatiques, doivent être pris au long cours (« à vie » disent souvent les malades), même quand les symptômes s’atténuent voire disparaissent.
Ils agissent sur les mécanismes de l’inflammation caractéristique des RIC, au sein des articulations bien sûr, mais aussi partout où elle peut se manifester : les muscles, le cartilage, les os, la peau, les poumons, les intestins…

Ils n’ont pas seulement pour objet de calmer les douleurs liées aux articulations enflammées, tellement intenses qu’elles amènent les personnes à consulter. Plus que cela, le grand nombre de molécules disponibles actuellement grâce aux progrès de la recherche permet de freiner voire d’arrêter l’évolution de la maladie, et d’éviter ou de réduire ses complications à long terme.
Ainsi l’objectif des rhumatologues pour leurs patients est dorénavant d’atteindre la rémission sous traitement : absence de douleurs, absence de gonflements, absence de raideurs matinales, normalisation de la CRP dans le bilan sanguin, amélioration de la qualité de vie…
Dans la polyarthrite rhumatoïde (PR), mais aussi dans le rhumatisme psoriasique, le traitement de fond doit être instauré « vite et fort » après le diagnostic. L’objectif est de freiner rapidement l’emballement du système immunitaire susceptible d’entraîner des érosions voire des destructions articulaires irréversibles. Le traitement mis en place en première intention est alors un traitement de fond synthétique : le méthotrexate.
Les traitements de fond synthétiques
Pour réaliser la synthèse de ces molécules, l’industrie pharmaceutique utilise des réactions chimiques.
Les traitements de fond synthétiques conventionnels
Ce sont les plus anciens, mais ils sont toujours largement prescrits dans le traitement des RIC associés à des atteintes périphériques (polyarthrite rhumatoïde et rhumatisme psoriasique principalement).
Parmi eux, le méthotrexate occupe une place de choix. Depuis les années 1980, il est devenu la « pierre angulaire du traitement de la polyarthrite rhumatoïde », à la dose de 0,3 mg/kg, une fois par semaine, soit 10 à 800 fois moins qu’en chimiothérapie anticancéreuse. Il s’administre par voie orale ou sous-cutanée, une fois par semaine à jour fixe, associé à de l’acide folique un autre jour.
Son effet n’est pas immédiat mais intervient au bout de 4 à 6 semaines. Le rhumatologue se donne 3 mois pour juger de son efficacité et attend une efficacité maximale à 6 mois. Si c’est insuffisant, il modifie sa stratégie thérapeutique.
D’autres traitements de fond conventionnels, tels que le léflunomide, la sulfasalazine ou l’hydroxychloroquine, peuvent remplacer le méthotrexate en cas de contre-indication ou lui être associé si son action est insuffisante. Dans le cas où, malgré une augmentation des doses, le méthotrexate n’a pas permis d’atteindre l’objectif escompté, il pourra aussi être remplacé par un biomédicament ou lui être associé.
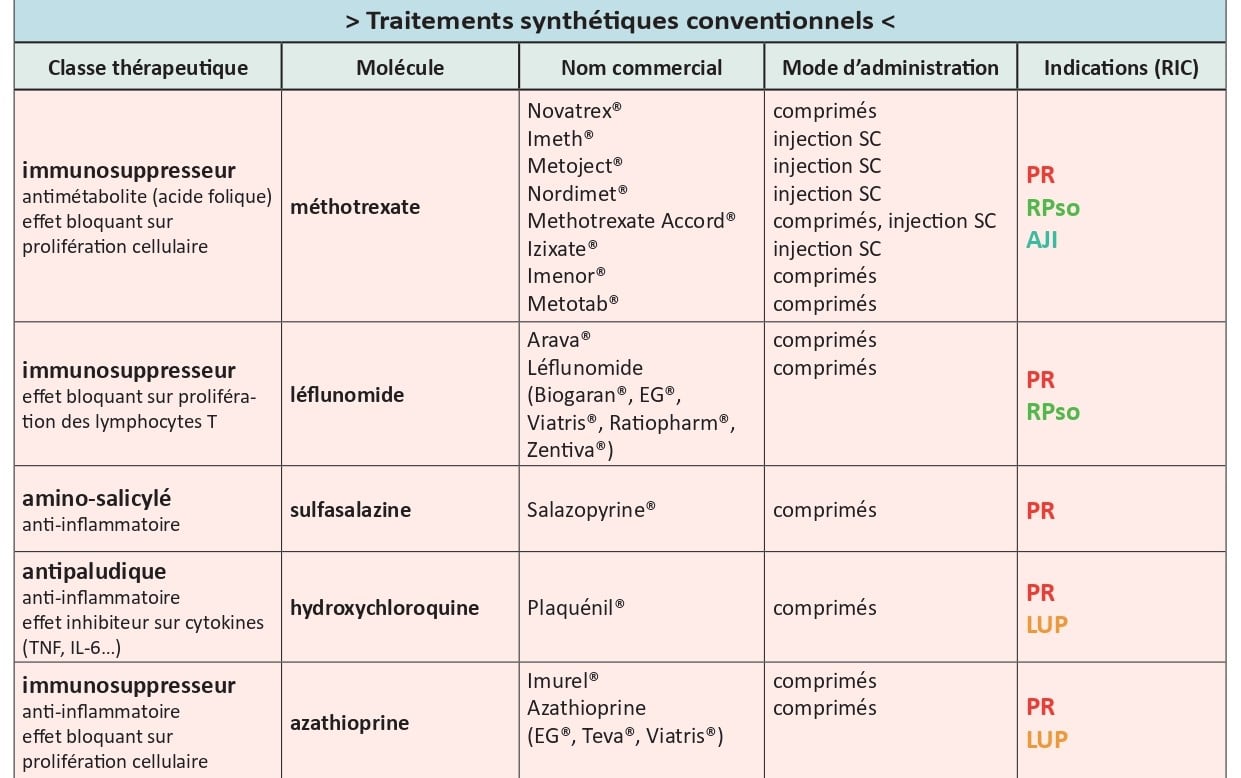
- Téléchargez le tableau complet des traitements de fond disponibles dans les rhumatismes inflammatoires chroniques
Pour en savoir plus :
- Téléchargez la brochure « Méthotrexate : connaître votre traitement pour plus d’efficacité et plus de sécurité »
- Visionnez la conférence « Le méthotrexate dans tous ses états », animée par le Pr Hubert Marotte, rhumatologue au CHU de Saint-Étienne
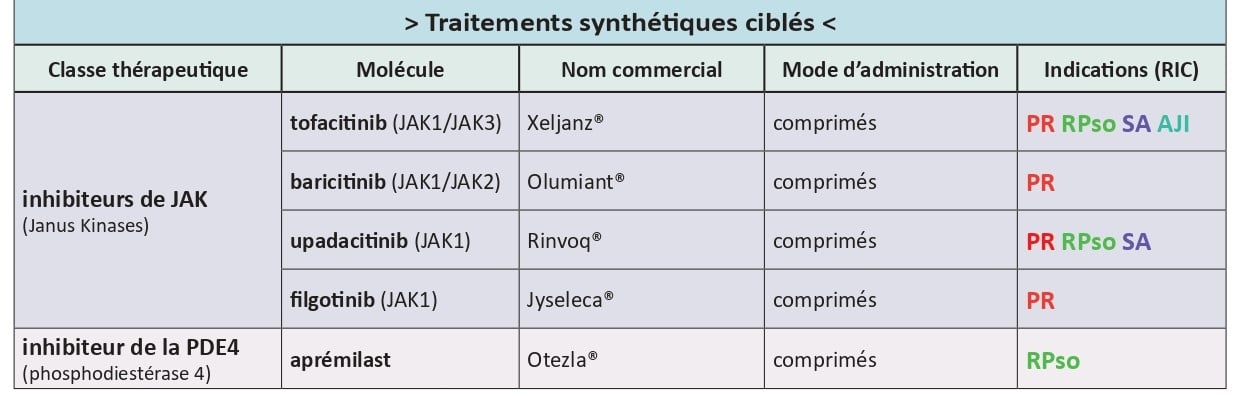
Les traitements de fond synthétiques ciblés
Comme les autres molécules issues de la synthèse chimique, ils sont administrés par voie orale. Ils sont dits « ciblés » par opposition aux « conventionnels », car ils agissent spécifiquement sur certaines voies de signalisation cellulaires impliquées dans les maladies inflammatoires chroniques. Ce sont de « petites molécules », par opposition aux « grosses molécules » que sont les biomédicaments.
Ils comportent l’apremilast et la classe des Inhibiteurs de Janus Kinases (JAKi), dont les deux premiers, le baricitinib et le tofacitinib, sont arrivés en France en 2017, suivis par l’upadacitinib et le filgotinib.
Les JAKi sont des molécules rapidement efficaces, prescrites en monothérapie, initialement à l’hôpital comme les autres thérapies ciblées que sont les biomédicaments. Ils sont parfois prescrits après échec du méthotrexate ou d’un autre traitement de fond conventionnel, mais le plus souvent en cas d’échec de biothérapie(s). Leur prescription n’est par ailleurs pas recommandée chez certains patients du fait de leur âge (65 ans et plus) et/ou de leurs facteurs de risques cardiovasculaires, thrombo-emboliques veineux ou de tumeur maligne.
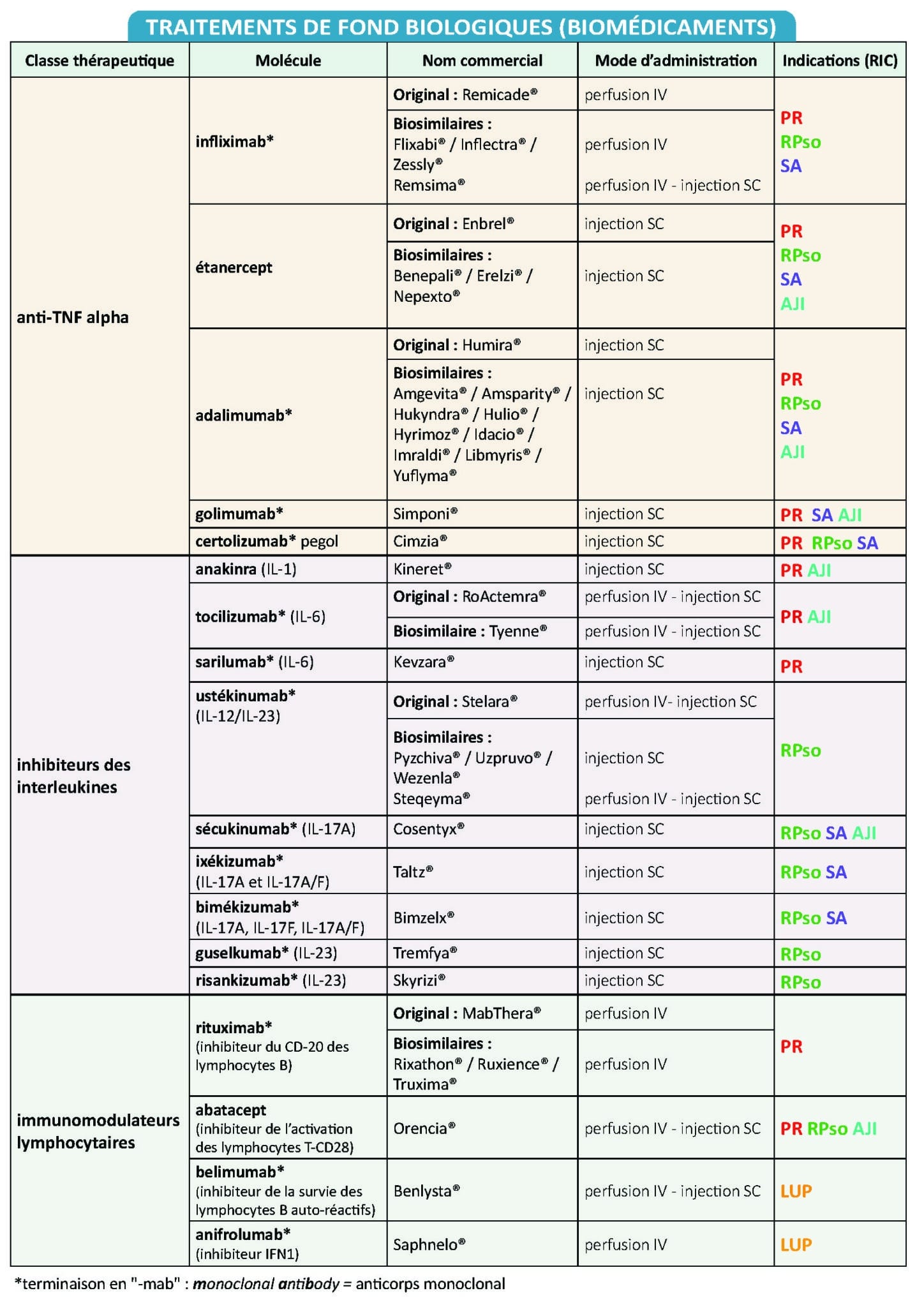
Les traitements de fond biologiques
« Biologiques » parce que le principe actif, qui mime souvent des composés de notre organisme, n’est pas fabriqué par des usines de synthèse chimique mais par des cellules-usines vivantes : des bactéries, des levures ou des cellules d’origine animale en culture.
La polyarthrite rhumatoïde a été la première des maladies inflammatoires auto-immunes à bénéficier des biomédicaments (ou biothérapies), commercialisés autour de l’an 2000. Les premiers anti-TNF alpha ont permis d’obtenir la rémission chez des patients qui ne répondaient pas, ou insuffisamment, au méthotrexate. Leur efficacité a ensuite a été démontrée dans la spondylarthrite ankylosante puis dans le rhumatisme psoriasique, le psoriasis et les maladies inflammatoires chroniques de l’intestin. Le recul est aujourd’hui suffisant pour que leur rapport bénéfices/risques soit bien connu. Depuis, leur nombre n’a cessé de croître grâce aux progrès de la recherche croisée en immunologie et rhumatologie. Cela permet au rhumatologue de proposer une nouvelle molécule en cas d’intolérance, mais aussi en cas d’échec d’un biomédicament, non efficace d’emblée ou perdant progressivement de son efficacité après avoir bien fonctionné durant plusieurs mois ou années (échappement thérapeutique).
De même que les JAKi, les biomédicaments sont des thérapies « ciblées » car dirigées contre des cibles précises :
– des cytokines (protéines médiatrices de l’inflammation) : anti-TNF alpha, anti-IL1, anti-IL6, anti-IL17, anti-IL23…
– des cellules de l’immunité : anti-lymphocyte B, anti-lymphocyte T.
Qu’il s’agisse d’anticorps monoclonaux ou de récepteurs solubles, en modulant le système immunitaire, ils permettent de réduire l’inflammation, les dégâts structuraux et les complications, cardiovasculaires notamment, et leurs effets indésirables sont bien plus modérés que ce qu’avaient craint les rhumatologues initialement.
Tous ne sont pas d’efficacité égale dans tous les rhumatismes inflammatoires chroniques. Le rhumatologue doit donc presque faire du sur-mesure afin que chaque patient bénéficie du biomédicament le plus adapté à lui et à sa pathologie.
Depuis 2015, les plus anciens des biomédicaments se déclinent sous forme de biosimilaires. Ces derniers sont cliniquement équivalents à leur molécule de référence qui a déjà une autorisation de mise sur le marché (AMM) et dont le brevet est tombé dans le domaine public, 20 ans après avoir été déposé. Ce sont des copies sûres du médicament original, dit « de référence » ou « princeps » : le laboratoire qui les commercialise a dû réaliser des tests montrant l’équivalence clinique entre son biosimilaire et l’original. Chaque année de nouveaux biosimilaires sont commercialisés, avec des dispositifs d’injection différents, qui peuvent orienter la préférence du patient et le choix de « son » biosimilaire, résultant d’une décision médicale partagée avec son rhumatologue.
Le principal intérêt des biosimilaires est leur prix, environ 20 % moins cher que le biomédicament de référence (dont le coût annuel s’élève en moyenne à 10 000 euros). Cette concurrence induit mécaniquement une baisse des prix, contribuant ainsi à diminuer le coût de ces traitements pour la collectivité et à permettre au plus grand nombre d’en bénéficier.
Les traitements symptomatiques
Les traitements symptomatiques traitent les symptômes de la maladie mais n’agissent pas en profondeur. Ils soulagent l’inflammation et la douleur pour quelques heures, sans agir sur les causes de la maladie, ni sur son activité. Ils ne peuvent donc pas empêcher son évolution naturelle préjudiciable, avec les dégâts qu’elle risque d’occasionner. Par ailleurs, du fait de leurs potentiels effets indésirables, ils n’ont pas vocation à être pris au long cours, d’autant que l’inflammation et les douleurs sont largement diminuées grâce aux traitements de fond.
La cortisone
Dans le langage courant, on parle de cortisone pour désigner ses dérivés de synthèse que sont les corticoïdes ou corticostéroïdes, auxquels on oppose les anti-inflammatoires non stéroïdiens (AINS).
Les rhumatologues utilisent principalement la prednisone et la prednisolone, pour leur effet anti-inflammatoire très puissant et rapide, particulièrement efficace pour soulager les poussées de polyarthrite rhumatoïde, surtout pendant les premiers mois après la mise en route du traitement de fond, le temps que celui-ci atteigne sa pleine efficacité. Les malades décrivent souvent un effet « magique » de la cortisone par voie orale sur les douleurs associées à leurs poussées. Pour autant, du fait de ses nombreux effets indésirables potentiels, la cortisone doit toujours être utilisée à la plus petite dose efficace et sur la période la plus courte possible (0,1 mg/kg quand elle est associée durant plusieurs mois à un traitement de fond).
Les anti-inflammatoires non stéroïdiens (AINS)
Les AINS sont prescrits en première intention par voie orale dans le traitement des spondyloarthrites, à dose efficace et le plus tard possible dans la journée, pour agir sur l’inflammation nocturne responsable des réveils et de l’enraidissement matinal. Il est possible d’en essayer plusieurs pour trouver celui qui fonctionne le mieux.
Les AINS et les corticoïdes peuvent également être administrés sous forme d’infiltrations à l’intérieur ou autour des articulations inflammatoires.
Les antalgiques
L’algie, ou la douleur, est le premier motif de plainte des malades. Les antalgiques sont des antidouleurs sans aucune action anti-inflammatoire.
Le plus utilisé d’entre eux est le paracétamol. Il peut être utilisé seul ou associé à un opioïde (molécule apparentée à la morphine) plus ou moins puissant : opium, tramadol… Certains opioïdes sont également commercialisés sans être associés au paracétamol.
Aucun antalgique n’est dénué d’effets secondaires, y compris le paracétamol. Le choix de l’antalgique, le moment de sa prise par rapport à la douleur ainsi que la durée du traitement, justifient un échange entre le médecin et le malade, comme pour l’ensemble des médicaments.
Les effets indésirables des traitements médicamenteux
Un médicament qui est actif présente toujours des risques d’effets indésirables.
Ce qui est primordial, pour chaque malade, c’est que le traitement fonctionne et permette le maintien voire une amélioration de la qualité de vie. Pour cela il faut que la balance bénéfices/risques penche du bon côté : que les effets indésirables du traitement ne soient pas délétères et qu’ils soient acceptables au regard de ses effets positifs. Cette balance est très individuelle et dépend de chacun.
Il faut donc que chaque malade connaisse les effets indésirables possibles de chacun des médicaments qu’il prend, afin de les identifier et de les gérer selon leur fréquence et leur gravité potentielle.

Si le médecin prescripteur et le pharmacien ont pour mission de délivrer une information, le patient a également un rôle à jouer, en s’informant par lui-même et en restant vigilant, à l’écoute de son corps, quand il est sous traitement. C’est l’information et la vigilance qui permettent de se poser les bonnes questions : « Est-ce que ce que je ressens a un lien avec mon traitement ? », « Cet effet indésirable est-il fréquent, ou bien rare ? », « Est-il acceptable pour moi au quotidien ? », « Peut-il être délétère ? », « Justifie-t-il de consulter en urgence mon médecin traitant ou mon rhumatologue ? D’échanger avec lui par téléphone ? De rapprocher un rendez-vous ? », « Le traitement doit-il être interrompu, diminué, poursuivi ? »…
La surveillance médicale régulière permet la plupart du temps d’échanger avec le médecin en cas de doutes, de questionnements et de ré-évaluer le traitement en cours si nécessaire.
Quelques effets indésirables des traitements de fond
- Des nausées apparaissent souvent lors des premières prises de méthotrexate, s’atténuant en général avec le temps.
- Le risque infectieux augmente sous traitement de fond, de manière modérée sous méthotrexate et plus élevée sous traitements ciblés (biomédicaments et inhibiteurs de JAK). Avant leur prescription initiale, un bilan est réalisé afin d’évaluer ce risque individuellement pour chaque patient, de l’en informer et de lui indiquer les mesures préventives, en matière de vaccination en particulier, ainsi que la conduite à tenir dans le cas où une infection se déclarerait.
- Le risque de cancers de la peau spino- ou baso-cellulaires augmente sous certains biomédicaments. Ces « petits cancers cutanés » ne peuvent pas entraîner de métastases, néanmoins ils doivent être enlevés par un dermatologue. Un rendez-vous annuel est conseillé.
- Les effets indésirables des JAKi en termes de risques cardiovasculaires et de cancers sont évalués de manière très stricte en amont de la prescription. Ils nécessitent, comme les autres traitements, une vigilance de la part des patients qui les prennent.
- Les traitements injectables peuvent occasionner des réactions de rougeurs et démangeaisons au point d’injection, sans caractère allergique, qui s’atténuent en général à la poursuite du traitement.
Quelques effets indésirables des traitements symptomatiques
- Les AINS provoquent fréquemment des douleurs à l’estomac. Ils nécessitent également une vigilance quant au risque cardiovasculaire.
- Les corticoïdes sont les traitements qui peuvent occasionner les effets indésirables les plus néfastes quand ils sont prescrits à dose élevée et sur des périodes prolongées. Ils favorisent alors l’ostéoporose, le diabète dit « cortico-induit », des anomalies du bilan lipidique, une fragilité de la peau, des troubles de l’humeur… et surtout un risque infectieux qui peut, à certaines doses, être supérieur à celui des biomédicaments.
- Le paracétamol, bien qu’il soit globalement bien toléré, peut entraîner de graves lésions pour le foie en cas de surdosage. (Ne jamais dépasser 4 g par jour en respectant un intervalle de 6 à 8 h entre chaque prise de 1 g.)
Les traitements non médicamenteux
Les traitements médicamenteux des rhumatismes inflammatoires chroniques ont révolutionné leur prise en charge. Pour autant, ils ne sont pas toujours suffisants pour venir à bout de certains symptômes (fatigue, douleurs, gênes fonctionnelles) et de leurs répercussions sur le quotidien.
Dans ce cas, d’autres traitements, non médicamenteux, peuvent alors s’avérer nécessaires pour gagner en qualité de vie.

Parmi eux, la kinésithérapie peut compléter le traitement des RIC à certaines périodes, ou même sur le long cours dans les spondyloarthrites. (En revanche, l’ostéopathie n’est pas recommandée quand elle est associée à une manipulation des articulations.)
Par ailleurs, de plus en plus de malades désirent être acteurs de leur prise en charge et pour cela se tournent vers les pratiques complémentaires. Hypnose, sophrologie, méditation, cures thermales… À chacun de tester pour trouver la (ou les) pratique(s) qui lui convient en prenant garde aux éventuelles dérives et contre-indications.
Enfin, l’activité physique est aujourd’hui reconnue comme faisant partie intégrante des traitements des rhumatismes inflammatoires chroniques et comme un moyen efficace de prévenir les complications liées à la maladie et aux traitements.
Pour en savoir plus :
- Visionnez la conférence « Quel traitement pour quel malade ? », animée par le Pr Yannick Allanore, rhumatologue à l’hôpital Cochin (Paris)
Sources :
- Dossier « Rhumatismes inflammatoires chroniques. Parlons de vos craintes », PolyArthrite infos n° 126, septembre 2022.
- Dossier « Les premiers pas avec la maladie… », PolyArthrite infos n° 121, juin 2021.
- « Les inhibiteurs de JAK. Quelle place dans le traitement des rhumatismes inflammatoires chroniques », Interview du Pr Jérôme Avouac, PolyArthrite infos n° 127, décembre 2022.
- Dossier « 20 ans après les premiers biomédicaments », PolyArthrite infos n° 118, septembre 2020.
- Dossier « Lorsqu’il faut suspendre ou changer son traitement », PolyArthrite infos n° 125, juin 2022.
- « La cortisone : pour le meilleur et pour le pire », Interview du Pr Francis Berenbaum, chef du service de rhumatologie de l’hôpital Saint-Antoine à Paris, PolyArthrite infos n° 120, avril 2021.
- Webconférence « Faut-il avoir peur des traitements des RIC ? », e-Salon de la PolyArthrite, octobre 2021.

